L’endométriose est une maladie handicapante qui touche 10 % des femmes. Aussi appelée cancer jaune de par le fait que cette maladie se comporte de manière similaire au cancer. Les symptômes varient beaucoup selon les personnes atteintes et le diagnostic se fait souvent tardivement.
L’endométriose c’est quoi ?
Les femmes atteintes d’endométriose ont les tissus de leur cavité utérine qui migrent vers les trompes jusqu’ici rien d’anormale ces derniers étant normalement expulsé de cette zone par des spasmes musculaires. Mais dans le cas de l’endométriose ils restent et adhèrent à la zone ou elle se sont fixés. Ces tissus peuvent migrer aussi au niveau de la vessie, des intestins, des reins voire même vers les autres organes du corps. Les chercheurs ont émis une hypothèse qui explique cela par le fait qu’a l’instar des métastases cancéreuses ces cellules migrent par voie sanguine et lymphatique. Ces tissus se comportent comme l’endomètre et suivent les cycles hormonaux. Aux moments des règles ces tissus saignent, ces saignements ne sont pas évacués, ils stagnent sous différentes forme (kystes, nodules…) et selon la localisation les symptômes sont différents et le nom est relié à la localisation.
Il existe plusieurs formes d’endométriose :
Endométriose pelvienne minime
Endométrioses ovariennes
Endométrioses digestives
Endométriose profonde (infiltrant la vessie, les uretères et/ou le rectum)
Endométriose extra-pelvienne (pariétale, diaphragmatique, thoracique)
Il existe également une forme interne au muscle de l’utérus : l’adénomyose. Aucune localisation ne peut être véritablement exclue.
Dans 80% des cas l’endométriose touche l’appareil génital uniquement, 20 % des cas pour l’endométriose digestive.
Les symptômes principaux de la maladie sont :
Dysménorrhées = douleurs en rapport avec les règles (douleurs au bas ventre, bas du dos…)
Dyspareunies = douleurs en rapport avec les rapports sexuels (douleurs plus ou moins profondes)
Dysuries = Douleurs urinaires (problèmes à la miction, infections à répétition…)
Dyschesies et autres troubles intestinaux (douleurs pour éliminer les selles, alternance diarrhée et constipation, ballonnements, gonflements…)
Douleurs pelviennes chroniques (douleurs aux ovaires, contractions utérines…
Asthénie = Fatigue chronique (sentiment d’épuisement, stations debout/assise difficiles…)
Douleurs de dos et d’épaules (douleurs lombaires, compression au niveau du diaphragme…)
Infertilité (insuffisance ovarienne, trompes atrophiées, problème à la nidation…)
Cette liste n’est pas exhaustive et ne remplace en aucun cas une consultation médicale avec un professionnel spécialiste de la maladie.
Une souffrance psychologique :
A ceci s’ajoute la souffrance psychologique qui handicape beaucoup les femmes touchées. Les traitements peuvent être lourds, la maladie peut être tabou et l’entourage peut ne pas comprendre. Cela créé un stress énorme et le sentiment d’être incomprise. Il peut en découler :
Dépression
Fatigue chronique
Manque de confiance en soi et en les autres
Isolement
Culpabilité
Difficulté à prendre soin de soi et des autres
Insomnie, stress chronique
Les causes :
Les causes ne sont pas clairement identifiées par la médecine. Voici les pistes étudiées :
· Les fuites de sang et de fragments d’endomètre en dehors de l’utérus., combiné au manque d’évacuation de ces derniers à cause de leur adhérence et d’un souci spasmodique des muscles qui ne permettent pas d’évacuer ces derniers.
· Des cellules de l’endomètre migreraient partout dans le corps par voies sanguine et lymphatique.
· des cellules du péritoine (la membrane qui soutient les organes de l’abdomen) pourraient spontanément se transformer en cellules de l’endomètre, sans qu’on en connaisse les causes. C’est l’hypothèse dite « métaplasique ».
L’apport de la naturopathie :
Travail du terrain :
La naturopathie est une pratique holistique c’est-à-dire qu’elle voit l’être dans son ensemble comme un tout. Le corps et l’esprit ne faisant qu’un. Ainsi en naturopathie on accorde beaucoup d’importance à l’origine des symptômes, à l’historique de la maladie, c’est l’anamnèse. Pour un même symptôme les causes sous-jacentes peuvent différer selon le cas. En naturopathie nous allons donc étudier cela au cas par cas. Nous allons étudier par le bilan de vitalité, le terrain pour voir comment le rééquilibrer. De sorte de travailler sur l’origine de l’endométriose. Par exemple l’utérus étant proche des intestins souvent il y’ a à l’origine un terrain digestif fragilisé qui de proche en proche a atteint l’utérus. Il a d’ailleurs été démontré que les femmes atteintes d’endométriose voyaient leur microbiote intestinal modifié (109). Or le microbiote intestinal est la base de notre immunité il communique et influe sur la santé de l’utérus. Dans le cas de l’endométriose il y a la cause des tissus d’endomètre qui migrent et adhèrent hors de l’utérus. Dans ce cas on rééquilibre ce terrain en régénérant la digestion, en nettoyant le système digestif en améliorant la vitalité intestinale en profondeur. Dans ce cas en rétablissant le système digestif cela favorise le retour au bien-être de l’utérus.
Travail sur les symptômes :
Pour ce faire on travaillera sur les causes directes :
Voies inflammatoires dans l'endométriose
L'endométriose est un trouble gynécologique complexe résultant de l'interaction de divers facteurs hormonaux, immunologiques et génétiques. Elle se caractérise notamment par une inflammation chronique et une angiogenèse accrue [ 1 ]. La réponse inflammatoire locale représente la principale voie d'initiation et de progression de la maladie [ 2 ]. Chez les femmes en bonne santé, le liquide péritonéal contient près de 85% de macrophages [ 3 ]. De nombreuses études ont révélé que le liquide péritonéal des femmes touchées contient des niveaux accrus de cellules immunitaires et de macrophages, entraînant une sécrétion accrue de prostaglandines, de cytokines, de facteurs de croissance et de facteurs angiogéniques, tels que le TNF-α, l'interleukine-1 (IL-1 ), l'interleukine-8 (IL-8), le facteur de croissance transformant bêta (TGF-β) et l'interféron-γ [4 ].
La prostaglandine E2 (PGE2) est un eicosanoïde doté de diverses fonctions physiologiques et pathologiques considérées comme indispensables au développement de l'endométriose. Selon Wu et al. [ 5 ], la PGE2 régule la prolifération cellulaire, l'angiogenèse, la suppression immunitaire et représente un point crucial dans le mécanisme moléculaire de l'endométriose [ 6 ].
L'environnement inflammatoire de cette maladie met en évidence une production accrue d'œstrogènes. Cet événement augmentera la production de Prostaglandines par l'activation à la fois du facteur nucléaire κB (NF-kB) et de la cyclooxygénase-2 (COX-2) [ 7 ]. Dans les zones endométriales ectopiques, les niveaux de COX-2 sont très augmentés. La PGE2 augmente les niveaux de COX-2 dans l'endomètre ectopique et eutopique. Un article de Banu et al. [ 8 ] ont mis en évidence l'influence de la COX-2 et de la PGE2 sur la promotion de la migration et de l'invasion des cellules de l'endomètre. En outre, l'inhibition de la COX-2 a pu réduire l'invasion des cellules épithéliales et stromales dans l'endométriose.
Les cellules endométriales eutopiques sont riches en sous-unités NF-k qui s'activent pendant la menstruation. L'activation de ces sous-unités dans les cellules endométriosiques in vitro a augmenté la sécrétion de cytokines pro-inflammatoires, IL-6, IL-8, ICAM-1, facteur de stimulation des colonies de granulocytes-macrophages (GM-CSF), TNF-α, facteur d'inhibition de la migration des macrophages (MIF) et MCP-1 [ 9 ]. L'inhibition de cette molécule chez les souris nude atteintes d'endométriose à un stade précoce a diminué la prolifération des cellules endométriosiques et stimulé l'apoptose dans les cellules stromales et épithéliales [ 10]. Le point de vue commun des chercheurs est que dans l'endométriose, NF-kappa B représente le lien entre le processus d'inflammation et l'expression de l'aromatase. L'activation des sous-unités NF-kappa B, suivie de la translocation du cytoplasme vers les noyaux cellulaires, représente la première étape pour induire le processus inflammatoire [ 11 ]. Le NF-kB activé libère IL-6, IL-8, IL-1, TNF-α et VEGF, conduisant à une inflammation chronique.
Le dysfonctionnement immunitaire caractérisé par des macrophages péritonéaux hyperactifs avec une capacité phagocytaire altérée représente un autre point clé dans le développement et la progression de l'endométriose. La capacité phagocytaire des macrophages est médiée par la sécrétion de métalloprotéinases matricielles (MMP). Ce sont des enzymes capables de détruire l'organisation de la matrice extracellulaire, et l'expression de plusieurs récepteurs de surface macrophages. Les MMP sont également capables de favoriser la dissolution des débris cellulaires [ 12 ].
Différentes altérations de l'activité des MMP sont considérées comme des facteurs déterminants dans le développement de l'endométriose [ 13,14 ]. La plupart des MMP sont sécrétées sous forme de pro-enzymes dormantes, qui seront ensuite activées via une action protéolytique. L'action des MMP est contrôlée par les inhibiteurs tissulaires des métalloprotéinases (TIMP) et par les inhibiteurs endogènes [ 15 ]. Des études récentes ont rapporté une expression accrue de MMP-9, -7, -3 et -2 chez les patientes atteints d'endométriose [ 16,17]. Des niveaux élevés de MMP-3 ont été observés dans des modèles animaux atteints d'endométriose induite [ 18]. La MMP-2, également connue sous le nom de gélatinase A, favorise la migration des cellules tumorales par la dégradation du collagène X, V et IV, qui représente une partie structurelle importante de la membrane basale [ 19 ]. Le liquide péritonéal des patientes endométriosiques contient des taux élevés de MMP-2 par rapport aux patientes en bonne santé [ 20 ]. De plus, l'expression de la MMP-2 dans le liquide péritonéal des femmes touchées a été positivement associée au niveau de 17β-estradiol et négativement associée aux taux sériques de progestérone [ 21 ].
Des rapports récents ont souligné le rôle majeur des espèces réactives de l'oxygène (ROS) dans l'inflammation liée à l'endométriose. Chez les individus en bonne santé, il existe un équilibre entre les ROS et les antioxydants. Lorsque cet équilibre se penche vers la surproduction de ROS, le stress oxydatif augmente, conduisant au processus inflammatoire via la régulation à la hausse de divers facteurs pro-inflammatoires [ 22,23 ]. Les radicaux hydroxyles sont considérés comme les espèces de radicaux libres les plus réactives [ 24 ]. Ils ont la capacité de réagir avec de nombreux constituants cellulaires tels que les résidus d'acides aminés, et également d'attaquer la coquille annulaire lipidique, conduisant à la peroxydation lipidique [ 25,26]. La production excessive de ROS provoque des dommages cellulaires et altère la fonction des cellules en contrôlant l'expression des gènes et l'activité des protéines [ 27,28 ]. Il a été démontré que ROS régule le facteur nucléaire κB (NF-κB), qui a été associé à l'endométriose [ 29 ]. NF-κB favorise l'expression de plusieurs gènes qui codent pour des cytokines pro-inflammatoires, des molécules d'adhésion, des facteurs angiogéniques et de croissance et des cyclooxigénases [2 , 29 ]. Ce processus conduit à l'activation des macrophages, à la prolifération des cellules endométriales et à une augmentation de l'adhésion et de la néovascularisation [ 30]. Le rôle essentiel des ROS dans l'endométriose consiste en la régulation positive des facteurs de transcription tels que NF-kB et activateur-protéine 1. Ces molécules régulent plusieurs gènes impliqués dans la défense cellulaire et dans l'expression de diverses cytokines pro-inflammatoires, intégrines et cadhérines [31 ].
L’angiogenèse et l’endométriose:
L'angiogenèse est un processus biologique qui consiste en la formation de nouveaux vaisseaux sanguins, l'augmentation de la sécrétion de facteurs de croissance, la dissolution de la matrice extracellulaire, la multiplication et l'agglutination des cellules endothéliales afin de former de nouveaux tubes ressemblant à des capillaires [ 32 ]. Ces nouveaux vaisseaux vont nourrir la cellule endométriale qui s’est fiée dans une zone inappropriée. Luter contre l’angiogenèse va aider à lutter contre la formation de nouveaux foyers endométriales.
L’apoptose et l’endométriose :
L'apoptose est décrite comme un processus physiologique, qui induit de graves modifications cellulaires, y compris la pycnose, la fragmentation nucléaire, la soufflure de la membrane plasmique et le rétrécissement cellulaire [ 40 ]. Le processus d'apoptose se termine par la production de petits fragments cellulaires, appelés corps apoptotiques. Les corps apoptotiques sont éliminés par phagocytose, sans augmenter une réponse pro-inflammatoire [ 41 ]. Dans l'endométriose, les cellules de l'endomètre possèdent la capacité d'éviter l'apoptose lorsqu'elles sont localisées dans les zones ectopiques.
Le processus apoptotique est déclenché par les caspases, un groupe d'enzymes protéases, qui déterminent le clivage des fragments C-terminaux en résidus d'acide aspartique lors de l'activation [ 42 ]. La principale classe de caspases est représentée par les homologues de caspase-9, également appelés «caspases effectrices» ou «initiateurs». Chez l'animal, un complexe composé de cytochromes, CED-4 / Apaf-1 et procaspase-9, appelé apoptosome, détermine l'activation de la procaspase-9, qui provoque l'effecteur caspase en cascade en aval, et par conséquent, la dégradation des cellules [ 43]. On considère que l'apoptose est déclenchée par voie extrinsèque, via l'interaction entre le TNFα, le ligand Fas (FasL / CD95L), le facteur de croissance transformant β (TGFβ), les caspases et la famille des lymphomes B-2 (Bcl-2). Différentes études ont souligné que l'endomètre des femmes endométriosiques exprime des niveaux inférieurs de facteurs pro-apoptotiques (par exemple, Bax) et des niveaux accrus de Bcl-2, un facteur anti-apoptotique, par rapport aux femmes non atteintes [ 44 ].
Des études récentes ont montré que les dérèglements des microARN (miARN) jouent un rôle dans le développement de l'endométriose [ 45 ]. L'analyse de miR-183 a révélé son implication dans l'induction de l'apoptose dans les cellules de l'endomètre humain. Une expression diminuée de miR-183 associée à l'endométriose conduit à une diminution de l'apoptose et, par la suite, à l'avancement de la maladie [ 46 ].
Les données existantes suggèrent que miR-191 supprime la mort cellulaire induite par le TNFα dans l'endomètre ectopique de patientes endométriosiques. De plus, miR-191 cible DAPK1, qui représente un médiateur de la mort cellulaire. Ainsi, la voie miR-191-DAPK1 pourrait non seulement être impliquée dans le développement de lésions endométriosiques, mais elle pourrait déterminer la transformation maligne de cette condition [ 47 ].
À notre avis, la connaissance des voies de signalisation moléculaire dans l'endométriose est essentielle pour choisir les stratégies thérapeutiques les plus appropriées pour vaincre cette énigmatique maladie gynécologique chronique.
Le dérèglement spasmodique de l’utérus :
Il y a un souci spasmodique, normalement ces cellules devrait être renvoyées d’où elles viennent. On pourra utiliser des plantes antispasmodiques comme l’achillée millefeuille ou l’huile essentielle d’estragon en externe (2 gouttes 3 fois par jour sur le bas ventre avec une pause d’une semaine toutes les 3 semaines) qui fera aussi office d’antidouleur lors des règles douloureuses notamment.
Rééquilibrer le cycle menstruel :
Pour rééquilibrer le cycle menstruel on pourra utiliser du macérat de bourgeon de framboisier (5 gouttes dans 1 verre d’eau 3 fois par jour) qui aidera à rééquilibrer les hormones. Je vous invite à regarder mon article sur les composés bioactifs agissant sur la progestérone.
Les plantes et l’endométriose :










Alimentation et endométriose :
L’alimentation en naturopathie est à adapter en fonction du terrain, de l’anamnèse et de la vitalité de la personne. Ainsi lors du bilan de vitalité de la première consultation le naturopathe voit ce qui est le plus adapté à la personne de manière individualisé. Il faudra veiller à vérifier s’il n’y a pas d’intolérance alimentaire à certains aliments comme le gluten, les produits céréaliers, ou les produits laitiers en les retirant de l’alimentation un à un chacun leur tour pendant 3 semaines et en constatant les changements. De manière générale il s’agira de manger sain. Les régimes du type régime méditerranéen, hypo-toxique ou encore le régime sans FOODMAP seront à étudier en fonction de votre cas. Il faudra veiller aux bonnes associations alimentaires et au bonne équilibre acido-basique de son alimentation. A avoir de bon apport alimentaire en vitamines, minéraux, et oligoéléments mais aussi au bon ration oméga3/oméga 6 qui doit être entre 1/3 et 1/5. Les oméga 3 étant anti-inflammatoire et les oméga 6 pro-inflammatoire.
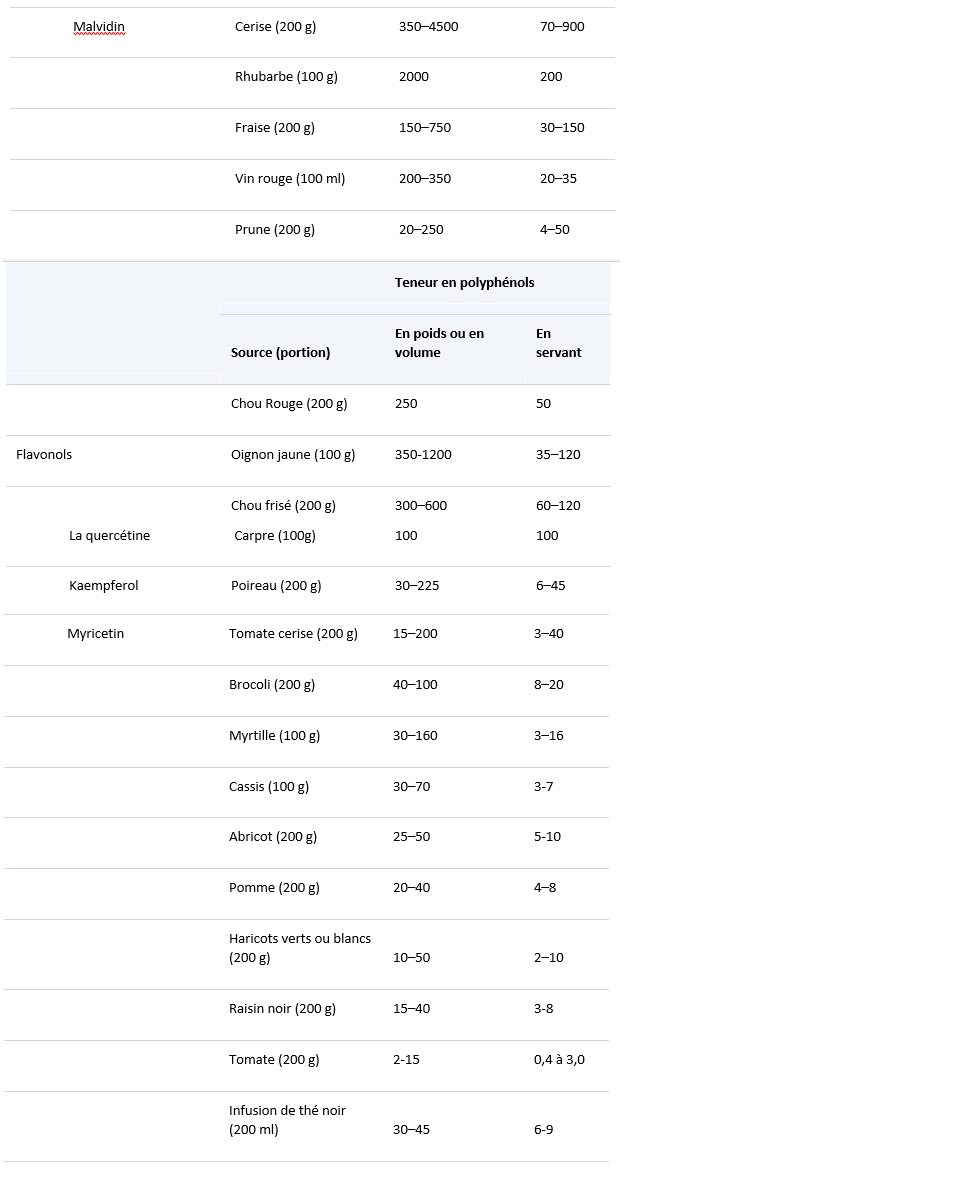
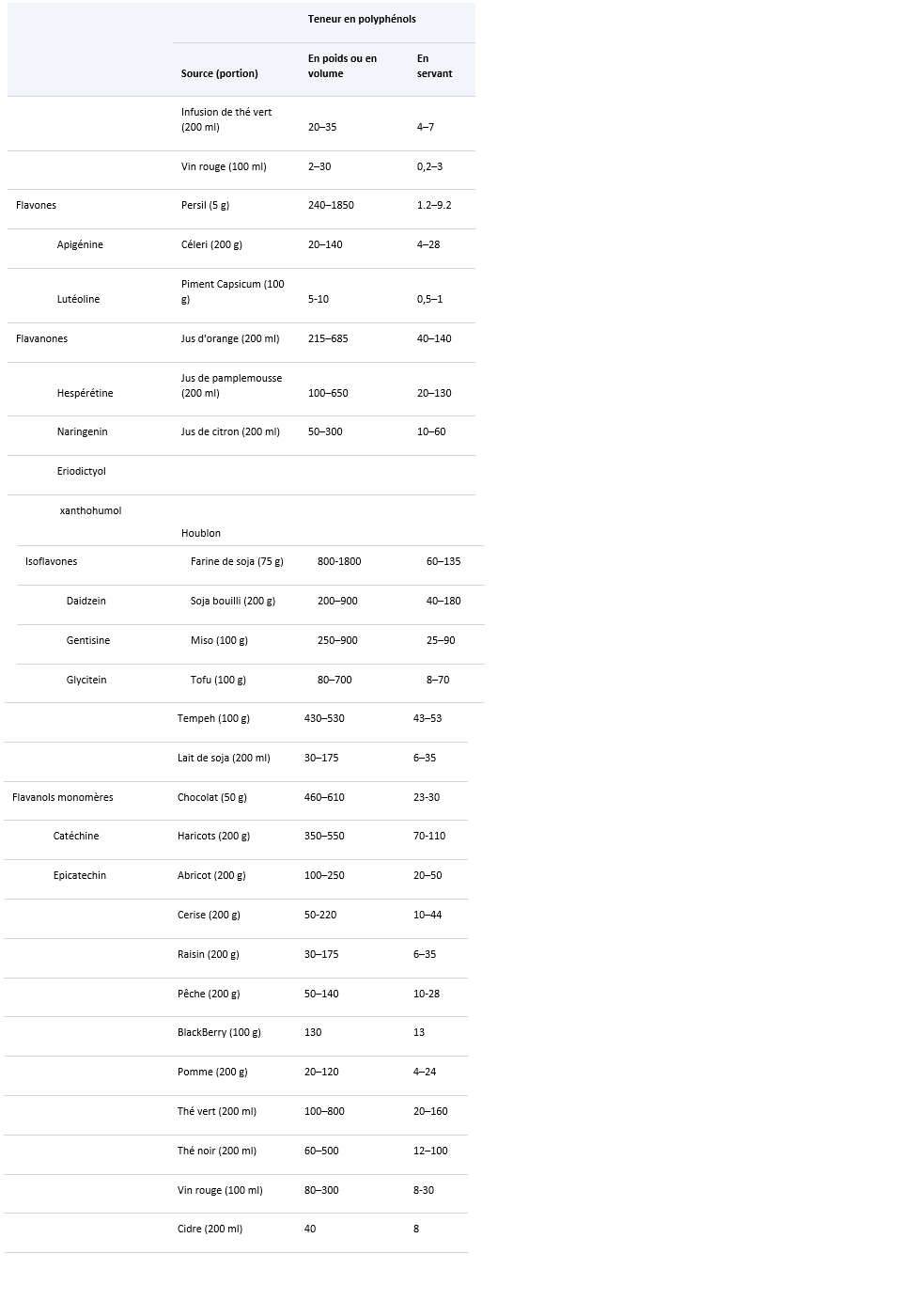
Polyphénols dans les aliments


Hérissé Jérôme votre naturopathe et magnétiseur passionné
Si vous souhaitez réserver votre téléconsultation cliquez ici ou appelez moi au 0684934372 pour un suivi en naturopathie ou en magnétisme.
Référence :
Zheng, W.; Cao, L.; Xu, Z .; Peut.; Liang, X. Médicaments alternatifs et complémentaires anti-angiogéniques pour le traitement de l'endométriose: un examen des mécanismes moléculaires potentiels. Evid. Complément. Altern. Med. 2018 , 2018 , 4128984. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Lousse, JC; Van Langendonckt, A .; Defrere, S .; Ramos, RG; Colette, S .; Donnez, J. L'endométriose péritonéale est une maladie inflammatoire. De face. Biosci. 2012 , 4 , 23–40. [ Google Scholar ] [ CrossRef ]
Oral, E .; Olive, DL; Arici, A. L'environnement péritonéal dans l'endométriose. Hum. Reprod. Mise à jour 1996 , 2 , 385–398. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Gazvani, R .; Templeton, A. Environnement péritonéal, cytokines et angiogenèse dans la physiopathologie de l'endométriose. Reproduction 2002 , 123 , 217–226. [ Google Scholar ] [ CrossRef ]
Wu, M.-H .; Shoji, Y .; Chuang, P.-C .; Tsai, S.-J. Endométriose: physiopathologie de la maladie et rôle des prostaglandines. Expert Rev. Mol. Med. 2007 , 9 , 1–20. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Wu, M.-H .; Lu, C.-W .; Chuang, P.-C .; Tsai, S.-J. Prostaglandine E2: le maître de l'endométriose? Exp. Biol. Med. 2010 , 235 , 668–677. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Narumiya, S.; Sugimoto, Y .; Ushikubi, F. Récepteurs prostanoïdes: structures, propriétés et fonctions. Physiol. Rev. 1999 , 79 , 1193-1226. [ Google Scholar ] [ CrossRef ]
Sugino, N.; Karube-Harada, A .; Taketani, T .; Sakata, A .; Nakamura, Y. Le retrait des stéroïdes ovariens stimule la production de prostaglandine F2alpha par l'activation du facteur nucléaire kappaB via des radicaux oxygène dans les cellules stromales de l'endomètre humain: pertinence potentielle pour la menstruation. J. Reprod. Dev. 2004 , 50 , 215-225. [ Google Scholar ] [ CrossRef ]
Banu, SK; Lee, J .; Speights, VO, Jr .; Starzinski-Powitz, A .; Arosh, JA Cyclooxygénase-2 régule la survie, la migration et l'invasion des cellules endométriosiques humaines à travers de multiples mécanismes. Endocrinology 2008 , 149 , 1180–1189. [ Google Scholar ] [ CrossRef ]
González-Ramos, R .; Van Langendonckt, A .; Defrère, S .; Lousse, JC; Colette, S .; Devoto, L .; Donnez, J. Implication de la voie du facteur nucléaire-κB dans la pathogenèse de l'endométriose. Fertil. Stérile. 2010 , 94 , 1985–1994. [ Google Scholar ] [ CrossRef ]
González-Ramos, R .; Van Langendonckt, A .; Defrère, S .; Lousse, JC; Mettlen, M .; Guillet, A .; Donnez, J. Les agents bloquant la voie du facteur nucléaire-κB sont des inhibiteurs efficaces de l'endométriose dans un modèle expérimental in vivo. Gynécol. Obstet. Enquête. 2008 , 65 , 174-186. [ Google Scholar ] [ CrossRef ]
Dull, A.-M .; Moga, MA; Dimienescu, OG; Sechel, G .; Burtea, V .; Anastasiu, CV Approches thérapeutiques du resvératrol sur l'endométriose via des voies anti-inflammatoires et anti-angiogéniques. Molecules 2019 , 24 , 667. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Wu, M.-H .; Hsiao, K.-Y .; Tsai, S.-J. L'endométriose et les marqueurs possibles de l'inflammation. Gynécol. Blanche. Invasive Ther. 2015 , 4 , 61–67. [ Google Scholar ] [ CrossRef ]
Brinckerhoff, CE; Matrisian, LM Matrix métalloprotéinases: Une queue de grenouille devenue prince. Nat. Rev. Mol. Cell Biol. 2002 , 3 , 207-214. [ Google Scholar ] [ CrossRef ]
Page-McCaw, A .; Ewald, AJ; Werb, Z. métalloprotéinases matricielles et la régulation du remodelage tissulaire. Nat. Rev. Mol. Cell Biol. 2007 , 8 , 221-233. [ Google Scholar ] [ CrossRef ]
Brew, K .; Nagase, H. Les inhibiteurs tissulaires des métalloprotéinases (TIMP): Une ancienne famille avec une diversité structurelle et fonctionnelle. Mol. Cell Res. 2010 , 1803 , 55–71. [ Google Scholar ] [ CrossRef ]
Osteen, KG; Yeaman, GR; Bruner-Tran, métalloprotéinases KL Matrix et endométriose. Semin. Reprod. Med. 2003 , 21 , 155-164. [ Google Scholar ] [ CrossRef ]
Paul, S .; Bhattacharya, P .; Mahapatra, P .; Swarnakar, S. Melatonin protège contre l'endométriose via la régulation de la matrice métalloprotéinase-3 et une voie apoptotique. J. Pineal Res. 2010 , 49 , 156-168. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Jana, S .; Paul, S .; Swarnakar, S. Curcumine comme agent anti-endométriosique: Implication de la MMP-3 et voie apoptotique intrinsèque. Biochem. Pharmacol. 2012 , 83 , 797–804. [ Google Scholar ] [ CrossRef ]
Iurlaro, M .; Loverro, G .; Vacca, A .; Cormio, G .; Ribatti, D.; Minischetti, M .; Ria, R .; Bruno, M .; Selvaggi, L. L'étendue de l'angiogenèse et l'expression de la métalloprotéinase-2 et 9 de la matrice sont en corrélation avec la mise à niveau et l'invasion du myomètre dans le carcinome de l'endomètre. EUR. J. Clin. Enquête. 1999 , 29 , 793–801. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Li, ZG; Lang, JH; Leng, JH; Liu, DY Augmentation des taux de prostaglandine E2 et bcl-2 dans le liquide péritonéal et le sérum des patients atteints d'endométriose. Zhonghua Fu Chan Ke Za Zhi 2005 , 40 , 598–600. [ Google Scholar ]
Huang, HF; Hong, LH; Tan, Y .; Sheng, JZ Matrix métalloprotéinase 2 est associée à des modifications des hormones stéroïdes dans le sérum et le liquide péritonéal des patients atteints d'endométriose. Fertil. Stérile. 2004 , 81 , 1235-1239. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Gupta, S .; Agarwal, A .; Krajcir, N.; Alvarez, JG Rôle du stress oxydatif dans l'endométriose. Reprod. BioMed. En ligne. 2006 , 13 , 126–134. [ Google Scholar ] [ CrossRef ]
Ruder, EH; Hartman, TJ; Blumberg, J .; Goldman, MB Stress oxydatif et antioxydants: exposition et impact sur la fertilité féminine. Hum. Reprod. Mise à jour 2008 , 14 , 345–357. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Aon, MA; Cortassa, S.; O'Rourke, B. Balance ROS optimisée Redox: Une hypothèse unificatrice. Biochim. Biophys. Acta. 2010 , 1797 , 865–877. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Agarwal, A .; Aponte-Mellado, A .; Premkumar, BJ; Shaman, A .; Gupta, S. Les effets du stress oxydatif sur la reproduction féminine: une revue. Reprod. Biol. Endocrinol. 2012 , 10 , 49. [ Google Scholar ] [ CrossRef ]
Van Langendonckt, A .; Casanas-Roux, F .; Donnez, J. Stress oxydatif et endométriose péritonéale. Fertil. Stérile. 2002 , 77 , 861–870. [ Google Scholar ] [ CrossRef ]
Guo, SW Nuclear Factor-κB (NF-κB): Un coupable majeur insoupçonné dans la pathogenèse de l'endométriose qui est toujours en fuite? Gynécol. Obstet. Enquête. 2007 , 63 , 71–97. [ Google Scholar ] [ CrossRef ]
González-Ramos, R .; Donnez, J .; Defrère, S .; Leclercq, I .; Squifflet, J .; Lousse, J.-C .; Van Langendonckt, A. Le facteur nucléaire kappa B est activé de manière constitutive dans l'endométriose péritonéale. Mol. Hum. Reprod. 2007 , 13 , 503–509. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Lousse, JC; Van Langendonckt, A .; González-Ramos, R .; Defrère, S .; Renkin, E .; Donnez, J. Augmentation de l'activation du facteur nucléaire-kappa B (NF-kappaB) dans les macrophages péritonéaux isolés de patients atteints d'endométriose. Fertil. Stérile. 2008 , 90 , 217–220. [ Google Scholar ] [ CrossRef ]
Dalton, TP; Shertzer, HG; Puga, A. Régulation de l'expression des gènes par l'oxygène réactif. Annu. Rev. Pharmacol. Toxicol. 1999 , 39 , 67–101. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Hey-Cunningham, AJ; Peters, KM; Zevallos, HB; Berbic, M .; Markham, R .; Fraser, IS Angiogenèse, lymphangiogenèse et neurogenèse dans l'endométriose. De face. Biosci. 2013 , 5 , 1033–1056. [ Google Scholar ] [ CrossRef ]
Gargett, CE; Masuda, H. Cellules souches adultes dans l'endomètre. Mol. Hum. Reprod. 2010 , 16 , 818–834. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Esser, S .; Lampugnani, MG; Corada, M .; Dejana, E .; Risau, W. Le facteur de croissance endothéliale vasculaire induit la phosphorylation de la VE-cadhérine tyrosine dans les cellules endothéliales. J. Cell Sci. 1998 , 111 Pt 13 , 1853–1865. [ Google Scholar ]
Kevil, CG; Payne, DK; Mire, E .; Alexander, JS Facteur de perméabilité vasculaire / La perméabilité médiée par le facteur de croissance des cellules endothéliales vasculaires se produit par désorganisation des protéines jonctionnelles endothéliales. J. Biol. Chem. 1998 , 273 , 15099-15103. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Ferrara, N. Rôle du facteur de croissance endothéliale vasculaire dans la régulation de l'angiogenèse physiologique. Un m. J. Physiol. Cell Physiol. 2001 , 280 , C1358-C1366. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Senger, DR; Claffey, KP; Benes, JE; Perruzzi, Californie; Sergiou, AP; Detmar, M. Angiogenèse favorisée par le facteur de croissance endothéliale vasculaire: régulation par les intégrines alpha1beta1 et alpha2beta1. Proc. Natl. Acad. Sci. USA 1997 , 94 , 13612-13617. [ Google Scholar ] [ CrossRef ]
Pardo, OE; Arcaro, A .; Salerno, G .; Raguz, S.; Vers le bas, J .; Seckl, MJ Fibroblast growth factor-2 induit une régulation traductionnelle de Bcl-XL et Bcl-2 via une voie dépendante de MEK. Corrélation avec la résistance à l'apoptose induite par l'étoposide. J. Biol. Chem. 2015 , 290 , 15390. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Lee, KF; Lee, YL; Chan, RW; Cheong, AW; Ng, EH; Ho, PC; Yeung, WS Régulation à la hausse du facteur de croissance endothélial vasculaire dérivé de la glande endocrine mais pas du facteur de croissance endothélial vasculaire dans le tissu endométriosique ectopique humain. Fertil. Stérile. 2010 , 93 , 1052-1060. [ Google Scholar ] [ CrossRef ]
Kerr, JF; Wyllie, AH; Currie, AR Apoptosis: Un phénomène biologique de base avec de vastes implications dans la cinétique tissulaire. Br. J. Cancer. 1972 , 26 , 239–257. [ Google Scholar ] [ CrossRef ]
Reed, JC Mécanismes de l'apoptose. Un m. J. Pathol. 2000 , 157 , 1415–1430. [ Google Scholar ] [ CrossRef ]
Galluzzi, L.; Vitale, I .; Abrams, JM; Alnemri, ES; Baehrecke, EH; Blagosklonny, MV; Dawson, TM; Dawson, VL; El-Deiry, WS; Fulda, S.; et coll. Définitions moléculaires des sous-programmes de mort cellulaire: Recommandations du Comité de nomenclature sur la mort cellulaire 2012. Cell Death Differ. 2012 , 19 , 107-120. [ Google Scholar ] [ CrossRef ]
Shi, Y. Aspects mécaniques de l'assemblage des apoptosomes. Curr. Opin. Cell Biol. 2006 , 18 , 677–684. [ Google Scholar ] [ CrossRef ]
Harada, T .; Taniguchi, F .; Izawa, M .; Ohama, Y .; Takenaka, Y .; Tagashira, Y .; Ikeda, A .; Watanabe, A .; Iwabe, T .; Terakawa, N. Apoptose et endométriose. De face. Biosci. 2007 , 12 , 3140–3151. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Pan, Q .; Luo, X .; Toloubeydokhti, T .; Chegini, N. Le profil d'expression du micro-ARN dans l'endomètre et l'endométriose et l'influence des stéroïdes ovariens sur leur expression. Mol. Hum. Reprod. 2007 , 13 , 797–806. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Shi, X.-Y .; Gu, L .; Chen, J .; Guo, X.-R .; Shi, Y.-L. La régulation à la baisse de miR-183 inhibe l'apoptose et améliore le potentiel invasif des cellules stromales de l'endomètre dans l'endométriose. Int. J. Mol. Med. 2014 , 33 , 59–67. [ Google Scholar ] [ CrossRef ] [ PubMed ]
Tian, X .; Xu, L.; Wang, P. MiR-191 inhibe l'apoptose induite par le TNF-α de l'endométriose ovarienne et des cellules de carcinome endométrioïde en ciblant DAPK1. Int. J. Clin. Exp. Pathol. 2015 , 8 , 4933–4942. [ Google Scholar ]
48. Xiong, Q.-X .; Ruan, X.-Y .; Deng, A.-P .; Liu, J .; Zhou, Q. Effet anti-endométriosique d'Angelica sinensis (Oliv.) Extrait de Diels dans les cellules endométriosiques humaines et les rats. Trop. J. Pharm. Res. 2020 , 19 , 817–821. [ Google Scholar ] [ CrossRef ]
49. Demirel, MA; Suntar, I .; Ilhan, M .; Keles, H .; Kupeli Akkol, E. Rémission de l'endométriose expérimentale chez les rats traités avec Achillea biebersteinii Afan.: Évaluation histopathologique et détermination des niveaux de cytokines. EUR. J. Obstet. Gynécol. Reprod. Biol. 2014 , 175 , 172-177. [ Google Scholar ] [ CrossRef ] [ PubMed ]
50. Mazandarani, M .; Osia, N.; Ghafourian, M. Activité antioxydante et enquête ethnopharmacologique sur Achillea biebersteinii Afan. dans le traitement de la dysménorrhée en médecine traditionnelle de la province du Golestan, Iran. J. Santé des femmes Reprod. Sci. 2015 , 3 , 107-110. [ Google Scholar ] [ CrossRef ]
51. Jaffal, SM; Abbas, MA L'action antinociceptive de l'extrait de fleur méthanolique d'Achillea biebersteinii est médiée par l'interaction avec le récepteur cholinergique dans des modèles de douleur chez la souris. Inflammopharmacology 2019 , 27 , 961–968. [ Google Scholar ] [ CrossRef ]
52. Cho, J.-H .; Lee, J.-G .; Yang, Y.-I .; Kim, J.-H .; Ahn, J.-H .; Baek, N.-I .; Lee, K.-T .; Choi, J.-H. L'eupatiline, un flavonoïde alimentaire, induit l'arrêt du cycle cellulaire G2 / M dans les cellules cancéreuses de l'endomètre humain. Food Chem. Toxicol. 2011 , 49 , 1737–1744. [ Google Scholar ] [ CrossRef ]
53. Han, J.-M .; Kim, M.-J .; Baek, S.-H .; An, S .; Jin, Y.-Y .; Chung, H.-G .; Baek, N.-I .; Choi, M.-S .; Lee, K.-T .; Jeong, T.-S. Effets antiathéroscléreux d'Artemisia princeps Pampanini cv. Sajabal chez les souris déficientes en récepteurs LDL. J. Agric. Food Chem. 2009 , 57 , 1267-1274. [ Google Scholar ] [ CrossRef ]
54. Kim, M.-J .; Han, J.-M .; Jin, Y.-Y .; Baek, N.-I .; Bang, M.-H .; Chung, H.-G .; Choi, M.-S .; Lee, K.-T .; Sok, D.-E .; Jeong, T.-S. Activités antioxydantes et anti-inflammatoires in vitro de la jaceosidine d'Artemisia princeps Pampanini cv. Sajabal. Arch Pharm. Res. 2008 , 31 , 429–437. [ Google Scholar ] [ CrossRef ] [ PubMed ]
55. Kim, K.-H .; Park, JK; Choi, Y.-W .; Kim, Y.-H .; Lee, EN; Lee, J.-R .; Kim, H.-S .; Baek, S.-Y .; Kim, B.-S .; Poireaux. L'extrait d'hexane d'ail noir vieilli réduit la prolifération cellulaire et atténue l'expression d'ICAM-1 et de VCAM-1 dans les cellules stromales de l'endomètre humain activées par TNF-α. Int. J. Mol. Med. 2013 , 32 , 67–78. [ Google Scholar ] [ CrossRef ]
56. Xiao, D.; Li, M .; Herman-Antosiewicz, A .; Antosiewicz, J .; Xiao, H .; Lew, KL; Zeng, Y .; Marynowski, SW; Singh, SV Diallyl trisulfide inhibe les caractéristiques angiogéniques des cellules endothéliales de la veine ombilicale humaine en provoquant l'inactivation d'Akt et la régulation à la baisse du VEGF et du VEGF-R2. Nutr. Cancer 2006 , 55 , 94–107. [ Google Scholar ] [ CrossRef ]
57. Hodge, G .; Hodge, S.; Han, P. Allium sativum (ail) supprime la production de cytokines inflammatoires leucocytaires in vitro: utilisation thérapeutique potentielle dans le traitement de la maladie inflammatoire de l'intestin. J. Quant. Cell Sci. 2002 , 48 , 209-215. [ Google Scholar ] [ CrossRef ] [ PubMed ]
58. Padiya, R .; Chowdhury, D.; Borkar, R .; Srinivas, R .; Pal Bhadra, M.; Banerjee, SK L'ail atténue le stress oxydatif cardiaque via l'activation de la voie PI3K / AKT / Nrf2-Keap1 chez le rat diabétique nourri au fructose. PLoS ONE 2014 , 9 , e94228. [ Google Scholar ] [ CrossRef ] [ PubMed ]
59. Avci, A .; Atli, T .; Ergüder, © B.; Varli, M .; Devrim, E .; Demir, Ö .; Durak, I .; Turgay, M. Effets de la consommation de raisin sur les paramètres antioxydants du plasma et des érythrocytes chez les sujets âgés. Turc J. Med. Sci. 2010 , 40 , 525-529. [ Google Scholar ] [ CrossRef ]
60. Kim, Y.-S .; Lim, E.-M .; Cho, H.-J. Effets de l'Astragalus membranaceus sur l'endométriose chirurgicale chez le rat. J. Obstet coréen. Gynécol. 2007 , 20 , 43–59. [ Google Scholar ]
61. Orkhon, B .; Kobayashi, K.; Javzan, B .; La racine de Sasaki, K. Astragalus induit la β-oxydation ovarienne et supprime la prolifération utérine dépendante des œstrogènes. Mol. Med. Rep. 2018 , 18 , 5198-5206. [ Google Scholar ] [ CrossRef ]
62. Zhao, R.-H .; Hao, Z.-P .; Zhang, Y .; Lian, F.-M .; Sun, W.-W .; Liu, Y .; Wang, R .; Long, L .; Cheng, L.; Ding, Y.-F. Contrôle de la récidive de l'endométriose pelvienne après une opération conservatrice: comparaison entre la phytothérapie chinoise et la médecine occidentale. Menton. J. Integr. Med. 2013 , 19 , 820–825. [ Google Scholar ] [ CrossRef ]
63. Kong, Y .; Zhang, J.-w. Étude expérimentale sur un modèle d'endométriose chez le rat traité avec du tamoxifène et de l'huile de rhizoma curcumae. J. Sichuan Univ 2006 , 37 , 596–598. [ Google Scholar ]
64. Swarnakar, S.; Paul, S. Curcumin arrête l'endométriose par une régulation négative de l'activité de la métalloprotéinase-9 de la matrice. Indian J. Biochem. Biophys 2009 , 46 , 59–65. [ Google Scholar ] [ PubMed ]
65. Uchio, R .; Higashi, Y .; Kohama, Y .; Kawasaki, K.; Hirao, T .; Muroyama, K.; Murosaki, S. Un extrait à l'eau chaude de curcuma (Curcuma longa) supprime les lésions hépatiques aiguës induites par l'éthanol chez la souris en inhibant le stress oxydatif hépatique et la production de cytokines inflammatoires. J. Nutr. Sci. 2017 , 6 , e3. [ Google Scholar ] [ CrossRef ]
66. Kumar, G .; Tajpara, P .; Maru, G. Le post-traitement diététique au curcuma diminue la croissance de la tumeur de la poche buccale de hamster induite par le DMBA en modifiant la prolifération cellulaire et les marqueurs liés à l'apoptose. J. Environ. Pathol Toxicol. Oncol. 2012 , 31 , 295–312. [ Google Scholar ] [ CrossRef ] [ PubMed ]
67. Yuliani, S .; Mustofa; Partadiredja, G. Les effets neuroprotecteurs d'un extrait de curcuma éthanolique ( Curcuma longa L.) contre le stress oxydatif induit par le triméthylétain chez le rat. Nutr. Neurosci. 2019 , 22 , 797–804. [ Google Scholar ] [ CrossRef ] [ PubMed ]
68. Kuo, C.-F .; Chyau, C.-C .; Wang, T.-S .; Li, C.-R .; Hu, T.-J. Activités antioxydantes et anti-inflammatoires accrues des produits fermentés de Monascus pilosus par addition de curcuma au milieu. J. Agric. Food Chem. 2009 , 57 , 11397-11405. [ Google Scholar ] [ CrossRef ]
69. Psotová, J .; Kolář, M .; Soušek, J .; Švagera, Z .; Vičar, J .; Ulrichová, J. Activités biologiques de l'extrait de Prunella vulgaris. Phytoter. Res. 2003 , 17 , 1082–1087. [ Google Scholar ] [ CrossRef ] [ PubMed ]
70. Collins, NH; Lessey, CE; DuSell, CD; McDonnell, DP; Fowler, L.; Palomino, WA; Illera, MJ; Yu, X .; Foule.; Houwing, AM; et coll. Caractérisation de l'activité anti-œstrogène de l'herbe chinoise, Prunella vulgaris, à l'aide de modèles in vitro et in vivo (xénogreffe de souris) 1. Biol. Reprod. 2009 , 80 , 375–383. [ Google Scholar ] [ CrossRef ]
71. Yin, DT; Lei, M .; Xu, J .; Li, H .; Wang, Y .; Liu, Z .; Mar.; Yu, K .; Li, X. L'herbe chinoise Prunella vulgaris favorise l'apoptose dans les cellules humaines de carcinome thyroïdien bien différenciées via la voie de signalisation lymphome-2 / Bcl-2-protéine X / caspase-3 associée. Oncol. Lett. 2017 , 14 , 1309–1314. [ Google Scholar ] [ CrossRef ] [ PubMed ]
72. Park, SH; Koo, HJ; Sung, YY; Kim, HK L'effet protecteur de l'extrait d'éthanol de Prunella vulgaris contre l'inflammation vasculaire dans les cellules musculaires lisses aortiques humaines stimulées par le TNF-α. BMB Rep. 2013 , 46 , 352–357. [ Google Scholar ] [ CrossRef ] [ PubMed ]
73. Sun, J .; Wei, Y.-H. Un nouveau glycoside alcaloïde-aluminium isolé de Rhizoma Sparganii (Sparganium stoloniferum Buch.-Ham.). J. Med. Plants Res. 2011 , 5 , 3128–3131. [ Google Scholar ] [ CrossRef ]
74. Sun, J .; Wang, S .; Wei, Y.-H. Toxicité pour la reproduction de Rhizoma Sparganii (Sparganium stoloniferum Buch.-Ham.) Chez la souris: mécanismes des activités pharmacologiques anti-angiogenèse et anti-oestrogéniques. J. Ethnopharmacol. 2011 , 137 , 1498-1503. [ Google Scholar ] [ CrossRef ]
75. Wu, Y.-z .; Sun, J .; Wang, Y.-b. Modulateur sélectif des récepteurs aux œstrogènes: Un nouveau polysaccharide de Sparganii Rhizoma induit l'apoptose dans les cellules cancéreuses du sein. Glucides. Polym. 2017 , 163 , 199–207. [ Google Scholar ] [ CrossRef ]
76. Jiang, Y.-Y .; Li, Y.-B .; Yu, J .; Chen, H .; Zhou, J .; Wang, L.; Zhang, L .; Zhao, M.-J .; Zhou, Y.-H .; Yu, L. Structure préliminaire et bioactivités du polysaccharide SMWP-U & E isolé de Salvia miltiorrhiza Bunge Residue. Int. j Biol. Mol. 2020 , 157 , 434–443. [ Google Scholar ] [ CrossRef ]
77. Wang, BQ Salvia miltiorrhiza examen chimique et pharmacologique d'une plante médicinale. J. Med. Plants Res. 2010 , 4 , 2813-2820. [ Google Scholar ]
78. Chen, Z.-z .; Gong, X. Tanshinone IIA contribue à la pathogenèse de l'endométriose via le système rénine-angiotensine en régulant la germination de l'axone ganglionnaire de la racine dorsale. Life Sci. 2020 , 240 , 117085. [ Google Scholar ] [ CrossRef ]
79. Liu, J.-J .; Lin, D.-J .; Liu, P.-Q .; Huang, M.; Li, X.-D .; Huang, R.-W. Induction de l'apoptose et inhibition des effets adhésifs et invasifs cellulaires par la tanshinone IIA dans les cellules de leucémie promyélocytaire aiguë in vitro. J. Biomed. Sci. 2006 , 13 , 813–823. [ Google Scholar ] [ CrossRef ]
80. Tsai, M.-Y .; Yang, R.-C .; Wu, H.-T .; Pang, J.-HS; Huang, S.-T. L'effet anti-angiogénique de la Tanshinone IIA implique l'inhibition de l'invasion de la matrice et la modification de la sécrétion de MMP-2 / TIMP-2 dans les cellules endothéliales vasculaires. Cancer Lett. 2011 , 310 , 198–206. [ Google Scholar ] [ CrossRef ]
81. Kim, SY; Moon, TC; Chang, HW; Fils, KH; Kang, SS; Kim, HP Effets de la tanshinone I isolée de Salvia miltiorrhiza Bunge sur le métabolisme de l'acide arachidonique et les réponses inflammatoires in vivo. Phytoter. Res. 2002 , 16 , 616–620. [ Google Scholar ] [ CrossRef ]
82. Zhou, Z.-H .; Weng, Q .; Zhou, J.-H .; Zhou, J. Extraits de Salvia miltiorrhiza bunge sur les cytokines de modèles d'endométriose de rat. Afr. J. Trad. Complément. Altern. Med. 2012 , 9 , 303–314. [ Google Scholar ] [ CrossRef ]
83. Tu, Q .; Wang, R .; Ding, B .; Zhong, W .; Cao, H.Effet protecteur et antioxydant des polysaccharides de Danshen sur l'ischémie cérébrale / les lésions de reperfusion chez le rat. Int. J. Biol. Macromol. 2013 , 60 , 268-271. [ Google Scholar ] [ CrossRef ] [ PubMed ]
84. Qian, Q .; Qian, S .; Fan, P .; Huo, D.; Wang, S.Effet de l'extrait hydrophile de Salvia miltiorrhiza sur les enzymes antioxydantes chez les patients diabétiques atteints de maladie cardiaque chronique: un essai contrôlé randomisé. Phytoter. Res. 2012 , 26 , 60–66. [ Google Scholar ] [ CrossRef ] [ PubMed ]
85. He, D.-Y .; Dai, S.-M. Effets anti-inflammatoires et immunomodulateurs de Paeonia lactiflora Pall., Une phytothérapie traditionnelle chinoise. De face. Pharmacol. 2011 , 2 , 10. [ Google Scholar ] [ CrossRef ] [ PubMed ]
86. Fan, Y.-X .; Hu, L.; Zhu, S.-H .; Han, Y .; Liu, W.-T .; Yang, Y.-J .; Li, Q.-P. La paeoniflorin atténue la douleur postopératoire en supprimant la matrice métalloprotéinase-9/2 chez la souris. EUR. J. Pain. 2018 , 22 , 272-281. [ Google Scholar ] [ CrossRef ]
87. Zhang, J .; Wang, F .; Wang, H .; Wang, Y .; Wu, Y .; Xu, H .; Su, C. La paeoniflorin inhibe la prolifération des cellules cancéreuses de l'endomètre via l'activation des voies de signalisation MAPK et NF-κB. Experim Ther. Med. 2017 , 14 , 5445-5451. [ Google Scholar ] [ CrossRef ] [ PubMed ]
88. Huang, Y .; Ohno, O .; Suenaga, K.; Miyamoto, K. Activité inductrice d'apoptose et effet antiprolifératif de la paeoniflorigénone du cortex de moutan. Biosci. Biotechnol. Biochem. 2017 , 81 , 1106-1113. [ Google Scholar ] [ CrossRef ]
89. Rop, O .; Reznicek, V .; Valsikova, M .; Jurikova, T .; Mlcek, J .; Kramarova, D. Propriétés antioxydantes du fruit de la canneberge européenne ( Viburnum opulus var. Edule). Molecules 2010 , 15 , 4467–4477. [ Google Scholar ] [ CrossRef ] [ PubMed ]
90. Moldovan, B .; David, L .; Vulcu, A .; Olenic, L .; Perde-Schrepler, M.; Fischer-Fodor, E .; Baldea, I .; Clichici, S .; Filip, GA Propriétés anti-inflammatoires in vitro et in vivo des nanoparticules d'argent synthétisées vertes à l'aide d' extrait de fruits de Viburnum opulus L. Mater. Sci. Engin. 2017 , 79 , 720–727. [ Google Scholar ] [ CrossRef ] [ PubMed ]
91. Saltan, G .; Süntar, I .; Ozbilgin, S.; Ilhan, M .; Demirel, MA; Oz, BE; Keleş, H .; Akkol, EK Viburnum opulus L.: Un remède pour le traitement de l'endométriose démontré par le modèle de rat de l'endométriose induite chirurgicalement. J. Ethnopharmacol. 2016 , 193 , 450–455. [ Google Scholar ] [ CrossRef ]
92. Zayachkivska, O .; Gzhegotsky, M .; Terletska, O .; Lutsyk, D.; Yaschenko, A .; Dzhura, O. Influence des proanthocyanidines de Viburnum opulus sur les lésions muqueuses gastro-intestinales induites par le stress. J. Physiol. Pharmacol. 2006 , 57 , 155. [ Google Scholar ]
93. Nagulendran, K.; Velavan, S.; Mahesh, R .; Begum, VH Activité antioxydante in vitro et contenu polyphénolique total des rhizomes de Cyperus rotundus. J. Chem. 2007 , 4 , 440–449. [ Google Scholar ]
94. Ahn, J.-H .; Lee, T.-W .; Kim, K.-H .; Byun, H .; Ryu, B .; Lee, K.-T .; Jang, DS; Choi, J.-H. Le 6-acétoxy cypérène, un sesquiterpène de type patchoulane isolé à partir de rhizomes de Cyperus rotundus, induit l'apoptose dépendante de la caspase dans les cellules cancéreuses de l'ovaire humain. Phytother Res. 2015 , 29 , 1330–1338. [ Google Scholar ] [ CrossRef ]
95. Sabbe, S.; Verbeke, W.; Deliza, R .; Matta, VM; Van Damme, P. Les consommateurs aiment les jus de fruits avec différentes concentrations d' açaï ( Euterpe oleracea Mart.). Food Sci. 2009 , 74 , S171 à S176. [ Google Scholar ] [ CrossRef ]
96. Machado, DE; Rodrigues-Baptista, KC; Alessandra-Perini, J .; Soares de Moura, R .; Santos, TAd; Pereira, KG; Marinho da Silva, Y .; Souza, PJC; Nasciutti, LE; Perini, JA Extrait d'Euterpe oleracea (Açaí) est un nouveau traitement pharmacologique thérapeutique prometteur pour l'endométriose expérimentale. PLoS ONE 2016 , 11 , e0166059. [ Google Scholar ] [ CrossRef ]
97. Del Pozo-Insfran, D.; Percival, SS; Talcott, ST Açai ( Euterpe oleracea Mart.) Les polyphénols sous leurs formes glycoside et aglycone induisent l'apoptose des cellules de leucémie HL-60. J. Agric. Food Chem. 2006 , 54 , 1222-1229. [ Google Scholar ] [ CrossRef ] [ PubMed ]
98. Xie, C.; Kang, J .; Li, Z .; Schauss, AG; Badger, TM; Nagarajan, S.; Wu, T .; Wu, X. La vélutine flavonoïde d'açaí est un puissant agent anti-inflammatoire: blocage de la production de TNF-α et d'IL-6 médiée par le LPS par l'inhibition de l'activation du NF-κB et de la voie MAPK. J. Nutr. Biochem. 2012 , 23 , 1184-1191. [ Google Scholar ] [ CrossRef ]
99. Zhou, J .; Zhang, J .; Wang, C .; Qu, S .; Zhu, Y .; Yang, Z .; Wang, L. Açaí ( Euterpe oleracea Mart.) Atténue les lésions hépatiques induites par l'alcool chez les rats en atténuant le stress oxydatif et la réponse inflammatoire. Exp. Ther. Med. 2018 , 15 , 166-172. [ Google Scholar ] [ CrossRef ]
100. Iravani, S .; Zolfaghari, B. Effets pharmaceutiques et nutraceutiques de l'extrait d'écorce de Pinus pinaster. Res. Pharm. Sci. 2011 , 6 , 1–11. [ Google Scholar ]
101. Maia Junior, H .; Haddad, C.; Casoy, J. Combinant des contraceptifs oraux avec un inhibiteur naturel du facteur nucléaire kappa B pour le traitement de la douleur liée à l'endométriose. Int. J. Women's Health 2013 , 6 , 35–39. [ Google Scholar ] [ CrossRef ]
102. Kohama, T .; Herai, K.; Inoue, M. Effet de l'extrait d'écorce de pin maritime français sur l'endométriose par rapport à l'acétate de leuproréline. J. Reprod. Med. Chicago 2007 , 52 , 703. [ Google Scholar ]
103. Yang, I.-H .; Shin, J.-A .; Cho, S.-D. Pycnogenol Induit La Translocation Nucléaire Du Facteur D'apoptose Et L'apoptose Indépendante De La Caspase Dans La Lignée Cellulaire De Carcinome Mucoépidermoïde Humain MC-3. J. Cancer Prev. 2014 , 19 , 265–272. [ Google Scholar ] [ CrossRef ] [ PubMed ]
104. Zhang, T .; Cong, H .; Zhao, S.; Zhang, Q .; Gu, X. Jing Tong Yu Shu, une médecine traditionnelle chinoise, supprime les expressions des gènes IL-1β et IL-6 dans les macrophages et atténue l'endométriose. Trop. J. Pharm. Res. 2017 , 16 , 2953-2958. [ Google Scholar ] [ CrossRef ]
105. Ilhan, M .; Ali, Z .; Khan, IA; Taştan, H .; Küpeli Akkol, E. Isolation guidée par la bioactivité des flavonoïdes d' Urtica dioica L. et leur effet sur le modèle de rat d'endométriose. J. Ethnopharmacol. 2019 , 243 , 112100. [ Google Scholar ] [ CrossRef ] [ PubMed ]
106. Masuda, Y .; Kikuzaki, H .; Hisamoto, M .; Nakatani, N. Propriétés antioxydantes des composés apparentés au gingérol du gingembre. Biofactors 2004 , 21 , 293–296. [ Google Scholar ] [ CrossRef ] [ PubMed ]
107. Wang, D.; Jiang, Y .; Yang, X .; Wei, Q .; Wang, H. 6-Shogaol réduit la progression de l'endométriose expérimentale in vivo et in vitro via la régulation du VGEF et l'inhibition des réponses inflammatoires médiées par COX-2 et PGE2. Coréen J. Physiol. Pharmacol. 2018 , 22 , 627–636. [ Google Scholar ] [ CrossRef ] [ PubMed ]
108. Zheng, W.; Wu, J .; Gu, J .; Weng, H .; Wang, J .; Wang, T .; Liang, X .; Cao, L. Caractéristiques modulaires et mécanisme d'action des herbes pour le traitement de l'endométriose en médecine chinoise: une exploration de données et une identification basée sur la pharmacologie en réseau. De face. Pharmacol. 2020 , 11 , 147. [ Google Scholar ] [ CrossRef ]








Comments